- Yazar Jason Gerald [email protected].
- Public 2024-02-01 14:16.
- Son düzenleme 2025-01-23 12:50.
Hiç bir şişe suyu birkaç saat sıcak güneşin altında bırakıp açtığınızda hafif bir "tıslama" sesi duydunuz mu? Bu, buhar basıncı adı verilen bir ilkeden kaynaklanmaktadır. Kimyada buhar basıncı, içindeki kimyasal madde buharlaştığında (gaza dönüştüğünde) kapalı bir kabın duvarları tarafından uygulanan basınçtır. Belirli bir sıcaklıkta buhar basıncını bulmak için Clausius-Clapeyron denklemini kullanın: ln(P1/P2) = (ΔHbuhar/R)((1/T2) - (1/T1)).
Adım
Yöntem 1/3: Clausius-Clapeyron Denklemini Kullanma
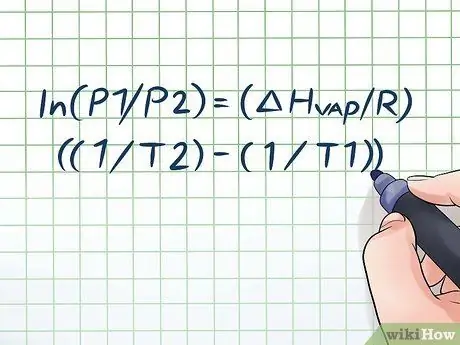
Adım 1. Clausius-Clapeyron denklemini yazın
Zamanla buhar basıncındaki değişimle birlikte buhar basıncını hesaplamak için kullanılan formüle Clausius-Clapeyron denklemi denir (isim fizikçiler Rudolf Clausius ve Benoît Paul mile Clapeyron'dan alınmıştır.) Bu temel olarak çoğu problem türünü çözmek için ihtiyaç duyacağınız formüldür. Buhar basıncı soruları genellikle fizik ve kimya derslerinde bulunur. Formül şöyle: ln(P1/P2) = (ΔHbuhar/R)((1/T2) - (1/T1)). Bu formülde, değişkenler şunları temsil eder:
-
Hbuhar:
Bir sıvının buharlaşma ısısı. Bu entalpi genellikle kimya ders kitabının arkasındaki tabloda bulunabilir.
-
R:
Gerçek/evrensel gaz sabiti veya 8.314 J/(K × Mol).
-
S1:
Buhar basıncının bilindiği sıcaklık (veya başlangıç sıcaklığı).
-
T2:
Buhar basıncının bilinmediği/bulunmak istenen sıcaklık (veya nihai sıcaklık).
-
P1 ve P2:
Sırasıyla T1 ve T2 sıcaklıklarında buhar basıncı.

Adım 2. Bildiğiniz değişkenleri girin
Clausius-Clapeyron denklemi karmaşık görünüyor çünkü birçok farklı değişkeni var, ancak doğru bilgiye sahipseniz aslında o kadar da zor değil. Çoğu temel buhar basıncı problemi, iki sıcaklık değeri ve bir basınç değeri veya iki basınç değeri ve bir sıcaklık değeri listeler - bunu bir kez anladığınızda, bu denklemi çözmek çok kolaydır.
- Örneğin, buhar basıncı 1 atmosfer (atm) olan 295 K'da sıvı dolu bir kabımız olduğu söylendiğini varsayalım. Sorumuz şu: 393 K'da buhar basıncı nedir? İki sıcaklık değerimiz ve bir basınç değerimiz var, bu yüzden Clausius-Clapeyron denklemini kullanarak diğer basınç değerlerini bulabiliriz. Değişkenlerimizi takarak, ln(1/P2) = (ΔHbuhar/R)((1/393) - (1/295)).
- Clausius-Clapeyron denklemi için her zaman sıcaklık değerini kullanmanız gerektiğini unutmayın. Kelvin. P1 ve P2 değerleri aynı olduğu sürece istediğiniz basınç değerini kullanabilirsiniz.

Adım 3. Sabitlerinizi girin
Clausius-Clapeyron denkleminin iki sabiti vardır: R ve Hbuhar. R her zaman 8.314 J/(K × Mol)'e eşittir. Ancak, Hbuhar (buharlaşma entalpisi) buhar basıncını aradığınız maddeye bağlıdır. Yukarıda belirtildiği gibi, genellikle H değerlerini bulabilirsiniz.buhar çeşitli maddeler için bir kimya veya fizik ders kitabının arkasında veya çevrimiçi olarak (örneğin burada olduğu gibi)
-
Örneğimizde, sıvımızın saf su.
Tabloya bakarsak H değerleribuharH olduğunu buluruzbuhar saf su yaklaşık 40.65 KJ/mol'dür. H değerimiz kilojul değil de joule cinsinden olduğundan, onu şuna çevirebiliriz: 40.650 J/mol.
- Sabitlerimizi takarak, elde ederiz ln(1/P2) = (40.650/8, 314)((1/393) - (1/295)).
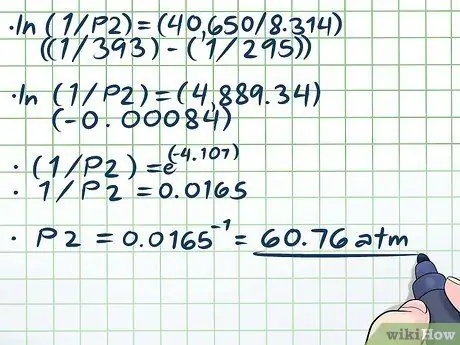
Adım 4. Denklemi çözün
Aradığınız değişken dışındaki tüm değişkenleri denkleme ekledikten sonra, denklemi adi cebir kurallarına göre çözmeye devam edin.
-
Denklemimizi çözmenin tek zor kısmı (ln(1/P2) = (40.650/8, 314)((1/393) - (1/295))) doğal günlüğü (ln) çözüyor. Doğal logu çıkarmak için, denklemin her iki tarafını da matematiksel sabit e için üs olarak kullanın. Diğer bir deyişle, ln(x) = 2 → eln(x) = e2 → x = e2.
- Şimdi denklemimizi çözelim:
- ln(1/P2) = (40.650/8, 314)((1/393) - (1/295))
- ln(1/P2) = (4889, 34)(-0, 00084)
- (1/P2) = e(-4, 107)
- 1/P2 = 0.0165
-
P2 = 0.0165-1 = 60, 76 atm.
Bu mantıklıdır - kapalı bir kapta, sıcaklığı neredeyse 100 dereceye (kaynama noktasının neredeyse 20 derece üstüne) yükseltmek çok fazla buhar üretecek ve basıncı hızla artıracaktır.
Yöntem 2/3: Çözünmüş Çözelti ile Buhar Basıncı Bulma
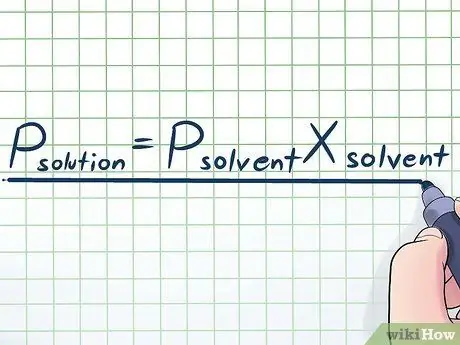
Adım 1. Raoult Yasasını yazın
Gerçek hayatta nadiren saf bir sıvıyla çalışırız - genellikle birkaç farklı maddenin karışımı olan bir sıvıyla çalışırız. En yaygın olarak kullanılan karışımlardan bazıları, bir çözelti yapmak için çözücü olarak adlandırılan birçok kimyasalda çözünen adı verilen belirli bir kimyasalın az bir miktarının çözülmesiyle yapılır. Bu durumlarda, Raoult Yasası olarak adlandırılan (fizikçi François-Marie Raoult'un adını taşıyan) bir denklemi bilmek faydalıdır ve şöyle yazılmıştır: Pçözünen=Pçözücüxçözücü. Bu formülde değişkenler;
-
Pçözünen:
Tüm çözeltinin buhar basıncı (tüm elementler birleştirildi)
-
Pçözücü:
çözücü buhar basıncı
-
xçözücü:
Çözücünün mol fraksiyonu
- Köstebek kesri gibi terimleri bilmiyorsanız endişelenmeyin - bunları sonraki birkaç adımda açıklayacağız.

Adım 2. Solüsyonunuzdaki solventi ve çözüneni belirleyin
Karışık bir sıvının buhar basıncını hesaplamadan önce kullandığınız maddeleri tanımlamanız gerekir. Hatırlatma olarak, bir çözünen bir çözücü içinde çözündüğünde bir çözelti oluşur - çözünen kimyasala her zaman çözünen denir ve onu çözündüren kimyasala her zaman çözücü denir.
- Tartıştığımız kavramları göstermek için bu bölümdeki basit örnekleri kullanarak çalışalım. Örneğimiz için, şeker şurubunun buhar basıncını bulmak istediğimizi varsayalım. Geleneksel olarak şeker şurubu suda çözünür şekerdir (1:1 oranında), yani şunu söyleyebiliriz. şeker bizim çözünenimiz, su ise çözücümüzdür.
- Sakkarozun (sofra şekeri) kimyasal formülünün C olduğuna dikkat edin.12H22Ö11. Bu kimyasal formül çok önemli olacaktır.
Adım 3. Çözeltinin sıcaklığını bulun
Yukarıdaki Clausius Clapeyron bölümünde gördüğümüz gibi, bir sıvının sıcaklığı buhar basıncını etkiler. Genel olarak, sıcaklık ne kadar yüksek olursa, buhar basıncı o kadar yüksek olur - sıcaklık yükseldikçe, daha fazla sıvı buharlaşacak ve buhar oluşturarak kaptaki basıncı artıracaktır.
Örneğimizde şeker şurubunun bu noktadaki sıcaklığı diyelim. 298 bin (yaklaşık 25 C).
Adım 4. Çözücünün buhar basıncını bulun
Kimyasal referans malzemeleri genellikle yaygın olarak kullanılan birçok madde ve bileşik için buhar basıncı değerlerine sahiptir, ancak bu basınç değerleri genellikle yalnızca maddenin sıcaklığı 25 C/298 K veya kaynama noktasına sahipse geçerlidir. Çözümünüz bu sıcaklıklardan birine sahipse, bir referans değeri kullanabilirsiniz, ancak değilse, o sıcaklıktaki buhar basıncını bulmanız gerekir.
- Clausius-Clapeyron yardımcı olabilir - P1 ve T1 için sırasıyla bir referans buhar basıncı ve 298 K (25 C) kullanın.
- Örneğimizde karışımımızın sıcaklığı 25 C olduğundan kolay referans tablomuzu rahatlıkla kullanabiliriz. 25 C'de suyun buhar basıncının 23,8 mm YG

Adım 5. Çözücünüzün mol fraksiyonunu bulun
Bunu çözmeden önce yapmamız gereken son şey, çözücümüzün mol fraksiyonunu bulmaktır. Mol fraksiyonunu bulmak kolaydır: sadece bileşiklerinizi mollere dönüştürün, ardından maddedeki toplam mol sayısı içindeki her bir bileşiğin yüzdesini bulun. Başka bir deyişle, her bileşiğin mol kesri eşittir (bileşik mol)/(maddedeki toplam mol sayısı).
-
Şeker şurubu kullanımları için tarifimizi varsayalım. 1 litre (L) su ve 1 litre sakaroz (şeker).
Bu durumda, her bir bileşiğin mol sayısını bulmalıyız. Bunu yapmak için, her bir bileşiğin kütlesini bulacağız, sonra maddenin molar kütlesini kullanarak onu mollere çevireceğiz.
- Kütle (1 L su): 1.000 gram (g)
- Kütle (1 L ham şeker): Yaklaşık 1.056, 8 g
- Mol (su): 1.000 gram × 1 mol/18.015 g = 55.51 mol
- Mol (sakaroz): 1.056, 7 gram × 1 mol/342.2965 g = 3.08 mol (sakarozun molar kütlesini kimyasal formülünden bulabileceğinizi unutmayın, C12H22Ö11.)
- Toplam mol: 55.51 + 3.08 = 58.59 mol
- Suyun mol oranı: 55, 51/58, 59 = 0, 947
Adım 6. Bitirin
Son olarak, Raoult Yasası denklemimizi çözmek için ihtiyacımız olan her şeye sahibiz. Bu kısım çok kolay: sadece bu bölümün başındaki basitleştirilmiş Raoult Yasası denklemindeki değişkenler için değerlerinizi girin (Pçözünen = Pçözücüxçözücü).
- Değerlerimizi girerek şunu elde ederiz:
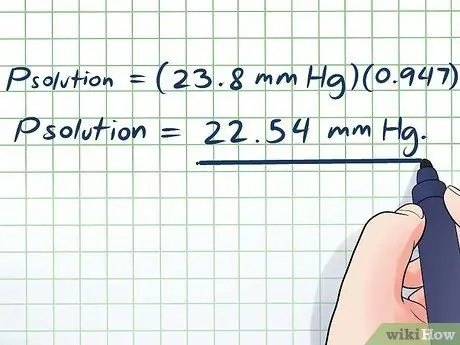
- Pçözüm = (23.8 mm Hg)(0, 947)
-
Pçözüm = 22.54 mm Hg.
Sonuç mantıklıdır - mol terimleriyle, çok suda çok az şeker çözülür (gerçi gerçek dünya terimleriyle, her iki bileşen de aynı hacme sahiptir), bu nedenle buhar basıncı yalnızca biraz azalacaktır.
Yöntem 3/3: Özel Durumlarda Buhar Basıncının Bulunması

Adım 1. Standart Sıcaklık ve Basınç koşullarına dikkat edin
Bilim adamları genellikle kullanımı kolay bir “standart” olarak bir dizi sıcaklık ve basınç değeri kullanırlar. Bu değerlere Standart Sıcaklık ve Basınç (veya STP) denir. Buhar basıncı sorunları genellikle STP koşullarına atıfta bulunur, bu nedenle bu değerleri hatırlamak önemlidir. STP değerleri şu şekilde tanımlanır:
- Sıcaklık: 273, 15 Bin / 0 C / 32F
- Baskı yapmak: 760 mm Hg / 1 atm / 101, 325 kilopaskal

Adım 2. Diğer değişkenleri bulmak için Clausius-Clapeyron denklemini yeniden düzenleyin
Bölüm 1'deki örneğimizde Clausius-Clapeyron denkleminin saf maddeler için buhar basıncını bulmak için çok faydalı olduğunu gördük. Ancak, tüm sorular sizden P1 veya P2'yi aramanızı istemeyecektir - çoğu sizden sıcaklık değerini ve hatta bazen H değerini bulmanızı isteyecektir.buhar. Neyse ki, bu durumlarda, cevabı doğru bulmak, denklemi, çözmek istediğiniz değişkenler eşittir işaretinin bir tarafında ayrı olacak şekilde yeniden düzenlemek meselesidir.
- Örneğin, 273 K'da 25 torr ve 325 K'da 150 torr buhar basıncına sahip bilinmeyen bir sıvımız olduğunu ve bu sıvının buharlaşma entalpisini (ΔH) bulmak istediğimizi varsayalım.buhar). Bunu şöyle çözebiliriz:
- ln(P1/P2) = (ΔHbuhar/R)((1/T2) - (1/T1))
- (ln(P1/P2))/((1/T2) - (1/T1)) = (ΔHbuhar/R)
- R × (ln(P1/P2))/((1/T2) - (1/T1)) = Hbuhar Şimdi değerlerimizi giriyoruz:
- 8, 314 J/(K × Mol) × (-1, 79)/(-0, 00059) = Hbuhar
- 8, 314 J/(K × Mol) × 3.033, 90 = Hbuhar = 25,223, 83 J/mol

Adım 3. Madde buhar ürettiğinde çözünen maddenin buhar basıncını hesaplayın
Yukarıdaki Raoult Yasası örneğimizde, çözünen maddemiz olan şeker normal sıcaklıklarda kendi başına herhangi bir basınç uygulamaz (bir düşünün - üst dolabınızda bir kap şekerin buharlaştığını en son ne zaman gördünüz?) buharlaşır, bu buhar basıncınızı etkiler. Bunu Raoult Yasası denkleminin değiştirilmiş bir versiyonunu kullanarak açıklıyoruz: Pçözüm = (Pbirleştirmekxbirleştirmek) Sigma (Σ) sembolü, cevabımızı almak için yalnızca farklı bileşiklerin tüm buhar basınçlarını toplamamız gerektiği anlamına gelir.
- Örneğin, iki kimyasaldan oluşan bir çözeltimiz olduğunu varsayalım: benzen ve toluen. Çözeltinin toplam hacmi 12 mililitredir (mL); 60 mL benzen ve 60 mL toluen. Çözeltinin sıcaklığı 25°C'dir ve bu kimyasalların her birinin 25°C'deki buhar basınçları benzen için 95.1 mm Hg ve toluen için 28.4 mm Hg'dir. Bu değerlerle çözeltinin buhar basıncını bulunuz. Bunu iki kimyasalımız için standart yoğunluk, molar kütle ve buhar basıncı değerlerini kullanarak şu şekilde yapabiliriz:
- Kütle (benzen): 60 mL = 0.060 L & x 876.50 kg/1.000 L = 0.053 kg = 53 gr
- Kütle (toluen): 0.060 L & x 866, 90 kg/1.000 L = 0.052 kg = 52 gr
- Mol (benzen): 53 g × 1 mol/78, 11 g = 0.679 mol
- Mol (toluen): 52 g × 1 mol/92, 14 g = 0,564 mol
- Toplam mol: 0.679 + 0.564 = 1.243
- Mol fraksiyonu (benzen): 0.679/1, 243 = 0.546
- Mol fraksiyonu (toluen): 0.564/1, 243 = 0.454
- Çözüm: Pçözüm = Pbenzenxbenzen + Ptoluenxtoluen
- Pçözüm = (95.1 mm Hg)(0, 546) + (28.4 mm Hg)(0, 454)
- Pçözüm = 51,92 mm Hg + 12,89 mm Hg = 64, 81 mm Hg
İpuçları
- Yukarıdaki Clausius Clapeyron denklemini kullanmak için sıcaklık Kelvin cinsinden ölçülmelidir (K olarak yazılır). Santigrat cinsinden sıcaklığa sahipseniz, aşağıdaki formülü kullanarak dönüştürmeniz gerekir: Tk = 273 + TC
- Enerji, uygulanan ısı miktarı ile tam olarak orantılı olduğu için yukarıdaki yöntemler kullanılabilir. Sıvının sıcaklığı, buhar basıncını etkileyen tek çevresel faktördür.






